Na základě povahy chemické vazby mezi částicemi (molekuly, atomy, ionty), které tvoří krystalovou strukturu, je zvykem rozlišovat čtyři typy krystalů: molekulární; kov; kovalentní (včetně polárních); iontový Než se zamyslíme nad hlavními typy krystalových mřížek, které se liší typem chemické vazby, zastavme se u jejich nejdůležitější charakteristiky – energie mřížky E mřížky krystalu. Energie mřížky je energie potřebná k rozkladu krystalu na částice, z nichž je složen, a jejich odstranění na nekonečnou vzdálenost od sebe. Energie mřížky se vztahuje k ideálnímu stavu krystalu při T = 0 K. V obecném případě mřížka E nezahrnuje vibrační energii částic, které tvoří krystal. Nelze ji tedy zaměňovat s vnitřní energií U. S rostoucí teplotou Eresh klesá v důsledku „uvolňování“ mřížky pod vlivem tepelných vibrací, zatímco vnitřní energie U roste. Energie mřížky je mírou stability konstrukce. Úzce souvisí s mnoha fyzikálními a mechanickými vlastnostmi pevných látek, například s tepelnou roztažností, body tání a varu, tvrdostí, elektrickou vodivostí atd.
Kapitola 2. Prvky krystalochemie
Výpočet Esolv je založen na analýze interakčních sil mezi částicemi umístěnými v uzlech krystalové mřížky. Je zřejmé, že čím silnější je interakce (síla vazby) mezi atomy, ionty nebo molekulami tvořícími mřížku, tím větší je hodnota Esolv. 2.3.1. Molekulární krystaly Krystaly, ve kterých převažuje molekulární typ vazby, se nazývají molekulární. Jsou sestaveny z jednotlivých molekul, jejichž atomy jsou spojeny kovalentními vazbami a mají velmi vysokou ionizační energii. Patří sem vzácné plyny v pevném skupenství (Ar, Xe, Kr, He aj.), některé organické krystaly a látky s nasycenými molekulami (O 2, N 2, HCl, CH 4). Jedná se o volné struktury s nízkými koordinačními čísly, nízkými teplotami tání a vypařování a vysokou stlačitelností. Molekulární krystaly jsou dielektrika propustná pro elektromagnetické vlny až po ultrafialové. Jak již bylo uvedeno, van der Waalsovy síly, které určují tvorbu molekulárních krystalů, jsou slabé a s rostoucí vzdáleností rychle klesají. Disperzní síly jsou centrální, nezávisí na počtu nejbližších sousedů a vyjadřují energii dipól-dipólové interakce. Se vzdáleností klesají v poměru k r–6. V důsledku slabých disperzních sil je energie mřížky E resh v molekulárních krystalech malá a výrazně menší než v jiných typech krystalů. V molekulárních krystalech tvořených dvouatomovými molekulami O 2, N 2 atd. (obr. 2.5) působí intramolekulární síly odpovědné za vznik molekul a mezimolekulární síly odpovědné za vznik krystalu. Kvantitativní charakteristikou intramolekulárních sil je energie disociace molekul na atomy. Je dost velký. Například disociační energie molekuly H 2 je 435,6 kJ mol –1. Mezimolekulární síly jsou van der Waalsovy síly. Jak již bylo naznačeno, vazebná energie těchto sil je malá. Pro molekulární krystaly H 2 je tedy vazebná energie ~ 1 kJ mol –1. Proto mají nízké teploty tání (například pro kovový vodík Tm = 13,8 K) a snadno sublimují.
Sekce 1. Základní principy fyzikálně-chemické krystalografie
Rýže. 2.5. Konvenční obraz molekulárního krystalu N 2. Tečkované čáry znázorňují jednotlivé molekuly N2 Plošně centrovaná krychlová struktura (viz obr. 1.10, b) je charakteristická pro mnoho molekulárních krystalů. 2.3.2. Kovové krystaly Nejdůležitější vlastností kovů je, že jejich valenční pás obsahuje neobsazené úrovně umístěné těsně nad Fermiho úrovní. Při excitaci se elektrony naplněných hladin blízkých Fermově hladině pohybují na volné hladiny při extrémně nízkých energetických hodnotách a mohou se snadno pohybovat po mřížce kovového krystalu. V elektrickém poli se zrychlují, pohybují se na vyšší energetické hladiny a absorbují malé množství energie. Tento pohyb je doprovázen přenosem elektrického náboje a následně vznikem elektrického proudu. Valenční elektrony v kovech jsou tedy kvazi volné (socializované) a mohou se snadno pohybovat celým objemem látky. Lze je porovnat s hypotetickým záporně nabitým elektronovým plynem (kapalinou), ve kterém je ponořena mřížka kladně nabitých iontových jader. Pomocí metod kvantové mechaniky se ukazuje, že taková struktura je rovnější než soubor identických izolovaných atomů, protože valenční elektrony v kovu podle
Kapitola 2. Prvky krystalochemie
Ve srovnání s volným atomem mají nižší kinetickou energii. Vazebná energie v kovových krystalech je proto relativně nízká (pro lithium Eb = 152,6 kJ mol –1, pro železo Eb = 404,2 kJ mol –1). Kovové vazby mají sférickou symetrii, což má za následek velká koordinační čísla a vysokou hustotu sbalení kovových struktur. Naprostá většina kovů krystalizuje buď do kubických plošně centrovaných těsně uzavřených struktur (viz obr. 1.10, b) (Ni, Ag, Au, Al, Pt, Fe, Cu, Pb), nebo do těsně uzavřených hexagonálních ( viz obr. 1.10, a) (Mg, Co, Zn, Cd, Bt, Ti, Zr). Tělesně centrovaná kubická mřížka (viz obr. 1.11, a) je charakteristická pro Cr, Mo, W, V, Ta atd. Kovové krystaly mají vysokou tepelnou vodivost, nízké hodnoty stlačitelnosti a koeficienty tepelné roztažnosti. Jejich vysoká plasticita a tvárnost jsou spojeny s možností vzájemného vytěsnění kationtů v krystalové mřížce kovu bez porušení chemické vazby. Pohlcují elektromagnetické vlny až do vzdálené ultrafialové oblasti. Nejdůležitější vlastností kovů je jejich vysoká elektrická vodivost, která se s rostoucí teplotou snižuje. Elektrony v kovu se pohybují náhodně a přecházejí z jednoho atomu na druhý. A kladně nabité ionty kolísají kolem své polohy v krystalové mřížce jen mírně. Díky přítomnosti volných elektronů, které nejsou navázány na určité atomy, kovy dobře vedou elektřinu. Při zahřívání kovu se vibrace kationtů zvyšují. Pro elektrony je obtížnější se mezi nimi pohybovat, takže se zvyšuje elektrický odpor kovu. Mnoho kovů může mít různé typy krystalových struktur (alotropní formy nebo modifikace) v pevném stavu při různých teplotách. Nízkoteplotní modifikace jsou označeny α, vysokoteplotní modifikace jsou označeny β, γ, δ atd. Pro většinu kovů, které procházejí polymorfními přeměnami, je charakteristické následující: nízkoteplotní modifikace mají těsně uzavřenou plošně centrovanou kubickou mřížku a vysokoteplotní modifikace mají kubickou strukturu zaměřenou na tělo. Obvykle se jedná o přechodné kovy.
Sekce 1. Základní principy fyzikálně-chemické krystalografie
2.3.3. Kovalentní krystaly Kovalentní (homeopolární) vazba nastává prostřednictvím elektronového páru. Vazba vzniká z touhy atomů zcela zaplnit své elektronové obaly a je obvykle tvořena dvěma elektrony s antiparalelními spiny, po jednom od každého z kombinujících se atomů. Povaha kovalentních vazeb je poměrně složitá a lze ji vysvětlit pouze pomocí aparátu kvantové mechaniky. Tyto problémy jsou diskutovány v odborné literatuře. Pro nás je důležitá jedna věc: na tvorbě vazby se podílejí pouze ty elektrony, které snižují celkovou energii systému. V kovalentní vazbě se všechny dostupné elektrony spárují a obíhají kolem dvou atomů. Žádný z elektronů se nemůže uvolnit a podílet se na elektrické vodivosti. Kovalentní krystaly proto v naprosté většině případů patří do třídy dielektrických materiálů. Počet atomů n, se kterými jsou elektrony sdíleny, závisí na valenci prvků a řídí se pravidlem: každý atom je spojen s (8 – N) nejbližšími sousedy, kde N je pořadové číslo skupiny, do které tento atom patří. Například atomy C, Ge, Si mají každý čtyři valenční elektrony (skupina IV periodické tabulky) a tvoří čtyři vazby se sousedními atomy. Kovalentní vazby se vyznačují přísnou směrovostí, proto v závislosti na jejich koordinaci tvoří dobře definované prostorové konfigurace. V krystalech uhlíku, křemíku a germania, které mají diamantovou strukturu, se tedy čtyři elektronové páry (bez ohledu na to, zda patří k jednomu nebo více atomům) nacházejí v prostoru v rozích pravidelného čtyřstěnu (viz obr. 1.14). , a). Ve strukturách s tetraedrickými vazbami může mít každý atom pouze čtyři nejbližší sousedy, zatímco v těsně uzavřených strukturách je počet nejbližších sousedů 12. V kovalentních krystalech jsou proto atomy uspořádány nekompaktně a tvoří struktury s malými koordinačními čísly a nízkým relativní hustoty balení (pro diamant – 4 a 0,34, v tomto pořadí). Díky vysoké vazebné energii (~ 245,8 kJ mol –1) se kovalentní krystaly vyznačují vysokými teplotami tání.
Kapitola 2. Prvky krystalochemie
Krystalová struktura diamantového typu je charakteristická pro většinu polovodičových sloučenin typu A III BV (GaSb, InSb, GaAs, InAs, GaP, InP). Sloučeniny typu A II B VI (CdSe, CdTe, ZnSe, ZnS, CdS) krystalizují ve struktuře sfaleritu (směs zinku) (viz obr. 1.14, b). 2.3.4. Iontové krystaly Většina dielektrických materiálů patří do třídy iontových krystalů. Všechny jsou to chemické sloučeniny se specifickým chemickým vzorcem (KCl, NaCl, NaOH) nebo mají proměnlivé stechiometrické složení, například (FeO) 1 – x (NiO) x (Fe 2 O 3 ). V iontových krystalech vytvářejí kladné a záporné ionty krystalovou mřížku v důsledku sil elektrostatické interakce. Na Obr. 1.13 a je znázorněna krystalová mřížka nejtypičtějšího iontového krystalu – chloridu sodného (NaCl). Je nemožné izolovat jednotlivé molekuly v iontovém krystalu. Každý kation je přitahován ke každému aniontu a odpuzován jinými kationty. Celý krystal lze považovat za obrovskou molekulu. Velikost takové molekuly není omezena, protože může růst přidáním nových kationtů a aniontů. V iontových krystalech je elektronové konfigurace vzácných plynů dosaženo díky přenosu valenčních elektronů atomů kovu na atomy nekovového prvku. V důsledku toho vznikají opačně nabité ionty, které pevně vážou valenční elektrony. Směr a výsledek elektronického přeskupení, ke kterému dochází během interakce dvou atomů, je určen množstvím energie uvolněné nebo absorbované během procesu interakce. Systém přejde do stavu, který odpovídá minimální hodnotě potenciální energie. Proto je proces tvorby nových vazeb a stabilních struktur energeticky prospěšný, protože je doprovázen uvolňováním energie. Je zřejmé, že pokud je elektronegativita X interagujících atomů stejná, pak je vazba mezi nimi blízká kovalentní. Čím větší X, tím větší je stupeň iontovosti vazby. Pokud je rozdíl v elektronegativitě atomů velký, pak je vazba čistě iontové povahy. Typicky se iontové vazby tvoří pouze mezi alkalickými kovy a halogenidy. V jiných případech je vazba přechodná mezi čistě kovalentní a čistě iontovou a nazývá se polární.
Sekce 1. Základní principy fyzikálně-chemické krystalografie
Vzhledem k tomu, že ionty krystalové mřížky mají elektronické konfigurace inertních plynů, má rozložení nábojů v nich sférickou symetrii. Proto jsou spoje v nich špatně směrovány. Povaha shlukování iontů v mřížce iontových krystalů je dána velikostí iontů a podmínkou pro vyrovnání Coulombových sil odpuzování a přitažlivosti. Protože každý iont má tendenci přitahovat co nejvíce iontů opačného znaménka, je koordinační číslo určeno poměrem poloměrů kovových a nekovových iontů. Poloměr nekovového iontu je vždy větší než poloměr kovového iontu, takže kovové ionty vyplňují dutiny v mřížce tvořené nekovovými ionty. V důsledku toho mají iontové krystaly tendenci k hustšímu balení s velkými koordinačními čísly. Pro iontové sloučeniny se stejným počtem kationtů a aniontů jsou známy čtyři hlavní typy krystalových mřížek: chlorid sodný (koordinační číslo obou iontů z = 6), chlorid česný (pro oba ionty z = 8), sfalerit a wurtzit (oba strukturní typy jsou charakterizovány koordinačním číslem kationtu a aniontu z = 4). Pokud je počet kationtů poloviční než počet aniontů, pak koordinační počet kationtů musí být dvojnásobkem koordinačního počtu aniontů. V tomto případě jsou realizovány strukturní typy fluorit (koordinační čísla – 8 a 4), rutil (koordinační čísla – 6 a 3), cristobalit (koordinační čísla – 4 a 2). Jako příklad na Obr. Obrázek 2.6 ukazuje schéma krystalové mřížky FeO s koordinačním číslem 4. Plocha centrovaná krychlová mřížka je tvořena ionty kyslíku a ionty železa jsou umístěny v dutinách. Každý iont Fe 2+ je obklopen šesti ionty O 2– a naopak. Proto v iontových krystalech není možné rozlišit dva ionty, které by mohly být srovnávány s molekulou. Pro výpočet mřížkové energie iontových krystalů byly dosud vyvinuty poměrně spolehlivé metody, např. Bornova – Mayerova, Born – Haberova metoda atd. Výpočty ukazují, že hodnota mřížkové energie E iontových krystalů je poměrně velká, srovnatelná s energií mřížky kovalentních krystalů a převyšuje E kovových a molekulárních krystalů (např. pro LiCl E řešit = 832,6 kJ mol –1). V tomto ohledu mají iontové krystaly vysokou teplotu tání a nízké koeficienty lineární roztažnosti a stlačitelnosti.
Kapitola 2. Krystalické chemické prvky
O 2– Fe 2+ Obr. 2.6. Schéma krystalové mřížky FeO Elektrická vodivost iontových krystalů je extrémně nízká (asi o 20 řádů menší než u kovů). Na rozdíl od kovalentních a kovových krystalů je jejich mechanismus vedení zásadně odlišný: tok elektrického proudu je způsoben difúzním pohybem iontů a je doprovázen přenosem hmoty. K difúzi dochází především v důsledku pohybu volných míst. V nepřítomnosti elektrického pole dochází k difúzním skokům náhodně, takže výsledný posun iontů v celém objemu je nulový. Při působení pole vzniká difúzní tok (kladné ionty se pohybují ve směru pole, záporné ionty v opačném směru), doprovázené přenosem náboje a hmoty. V roztaveném stavu jsou látky, které tvoří iontové krystaly, elektricky vodivé. Po rozpuštění ve vodě se tyto látky disociují na kationty a anionty. Výsledné roztoky vedou elektrický proud. Vysoká rozpustnost v polárních rozpouštědlech doprovázená elektrolytickou disociací je způsobena tím, že v prostředí rozpouštědla s vysokou dielektrickou konstantou ε klesá přitažlivá energie mezi ionty. Dielektrická konstanta vody je 82krát vyšší než dielektrická konstanta vakua (v porovnání s dielektrickou konstantou v iontovém krystalu) a přitažlivost mezi ionty ve vodném roztoku klesá o stejnou hodnotu. Účinek je zesílen solvatací iontů.
Vlastnosti látek v pevném skupenství agregace jsou dány nejen složením atomů, iontů, molekul, ale i jejich vzájemným uspořádáním.
Uspořádání konstrukčních celků může být uspořádané nebo neuspořádané. V souladu s tím se pevné látky nacházejí v krystalický и amorfní státy.
.jpg)
Krystaly – Jedná se o pevné látky s uspořádaným uspořádáním strukturních jednotek (atomů, iontů, molekul). Krystaly mají přirozený tvar mnohostěnu, uspořádání strukturních jednotek je symetrické a mnohokrát se opakuje (obr. 35).
Strukturní jednotky látek molekulární struktury jsou molekul. Například strukturní jednotkou vody je molekula složení H2O, který se nachází v pevném, kapalném a plynném skupenství. Avšak pouze v ledových krystalech jsou molekuly vody uspořádány uspořádaně, to znamená v určité vzdálenosti, pod určitým úhlem a tvoří pravidelnou krystalickou strukturu.
V látkách nemolekulární struktury jsou nejmenšími strukturními jednotkami atomy nebo ionty. Mezi takové látky patří kovy (Na, Cu, Fe) a nekovy (B a Si, diamant a grafit, červený fosfor), sloučeniny kovů s nekovy (NaCl, NaH, Na2SO4CuCl2, Fe2O3) a nekovy s nekovy (SiC, SiO2).
В amorfní stav V uspořádání konstrukčních celků není řád. V amorfním stavu se nachází například sklo, pryskyřice, parafín, polyethylen a saze.
Strukturu, vlastnosti a způsoby získávání krystalických látek studuje krystalchemie. Každá krystalická látka má svou krystalovou strukturu a odpovídající krystalový tvar (obr. 36). Halitové krystaly (NaCl) jsou krychlové krystaly křemene (SiO2) – šestiboký hranol.

Struktura molekul je znázorněna pomocí strukturních vzorců a prostorové uspořádání atomů, iontů a molekul v krystalech je znázorněno pomocí krystalové mřížky.
Pokud spojíte částice, které tvoří krystal, s konvenčními čarami, získáte prostorový rámec nazývaný krystalová mřížka. Průsečíky takových čar se nazývají uzly krystalové mřížky. Poloha uzlů mřížky modeluje uspořádání strukturních jednotek krystalu – atomů, iontů nebo molekul.
Chemická vazba v krystalech
Tabulka 13 shrnuje hlavní charakteristiky krystalických látek s různými typy chemických vazeb.
Tabulka 13. Typy krystalů a jejich vlastnosti
| Konstrukční jednotky, vlastnosti | Typy krystalů, strukturní jednotky | |||
| Atomový | Iontový | Metal | Molekulární | |
| Nekovové atomy | Ionty | Kovové atomy | Molekuly | |
| Typ spoje a jeho pevnost | Kovalentní, odolný | Iontové, odolné | Kov, síla v širokém rozsahu | Slabá mezimolekulární interakce |
| Elektrická a tepelná vodivost | Od dielektrik po polovodiče | Proud se provádí roztoky a taveninami | Dobrá elektrická a tepelná vodivost | Nízká tepelná vodivost, obvykle dielektrika |
| Plastický | křehký | křehký | Většinou tažný (kujný) | Anorganické látky jsou obvykle křehké |
| Tvrdost | Vysoký | Vysoký | Velmi se liší | Zpravidla nízké, s výjimkou fulleritu |
| Body tání a varu | Velmi vysoko | Střední až vysoká | Velký rozsah | Nízká |
| Rozpustnost | Nerozpustný | Může se rozpustit ve vodě a jiných polárních rozpouštědlech | Nerozpustný nebo může reagovat s vodou | Může se rozpouštět v polárních nebo nepolárních rozpouštědlech |
| Příklady látek | Diamant, grafit, křemík, SiO2, SiС | Oxidy, hydroxidy a soli alkalických kovů a kovů alkalických zemin | Kovy, slitiny kovů | Kyseliny, oxidy nekovů (kromě křemíku), nekovy (např.4, S8, I2), organická hmota |
Rozlišovat atomový (kovalentní vazba), iontový (iontová vazba), kovu (kovová vazba) a molekulární krystaly. Molekulární krystaly sestavené z jednotlivých molekul, ve kterých jsou atomy spojeny kovalentními vazbami a mezi molekulami působí slabší vazby mezimolekulární síly. Molekulární krystaly tvoří známý cukr, aspirin, oxid uhličitý („suchý led“) a vodu (led) (obr. 37).

Závislost vlastností látek na typu krystalové struktury
Vlastnosti pevných látek závisí na struktuře krystalů a síle chemických vazeb v nich. Například uhlík tvoří několik typů krystalových struktur. Jednou z nich je struktura diamantu, ve které každý atom uhlíku tvoří čtyři kovalentní vazby stejné síly se čtyřmi sousedními atomy uhlíku umístěnými ve vrcholech čtyřstěnu (obr. 38). Diamant je díky své struktuře nejtvrdší přírodní látkou (příloha 2). Karborundum SiC a borazon BN mají podobnou krystalickou strukturu a tvrdost blízkou diamantu.
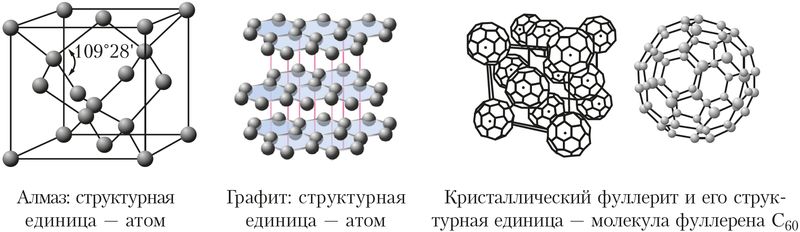
Dalším typem krystalického uhlíku je grafit. V grafitu jsou atomy uhlíku uspořádány ve vrstvách. Ve vrstvách používá každý atom uhlíku tři své elektrony k vytvoření tří kovalentních vazeb se sousedními atomy. Čtvrtý elektron se podílí na tvorbě delokalizovaných π vazeb a může se volně pohybovat po vrstvě. Proto má grafit elektrickou vodivost a používá se k výrobě elektrických kontaktů, vodivých maziv, elektrod atd.
Vzdálenost mezi vrstvami grafitu je mnohem větší než mezi atomy ve vrstvě. Proto se grafit snadno odlupuje. Díky této vlastnosti se z grafitu vyrábí tuhy pro tužky, je součástí různých maziv snižujících tření a sám je pevným mazivem ve formách na odlévání kovů.
Třetí krystalická modifikace uhlíku je fullerit – tvořené molekulami fullerenu C60skládající se z 60 atomů uhlíku.
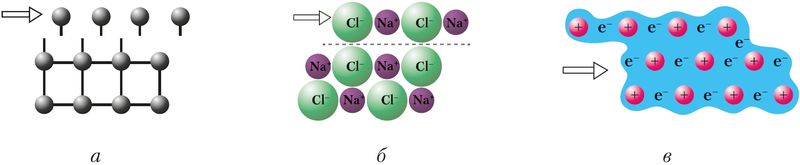
Atomové, iontové a kovové krystaly se liší odolností proti mechanické deformaci, která má za následek posun jednotlivých vrstev krystalové struktury (obr. 39). V tomto případě adheze mezi vrstvami v atomových krystalech (а) se láme v důsledku porušení chemických vazeb mezi atomy a v iontových vazbách – v důsledku odpuzování podobně nabitých iontů (б). V kovových krystalech se díky zvláštnostem kovové vazby krystaly nezničí, ale deformují. Proto jsou kovy tažné (kujné), zatímco atomové a iontové krystaly jsou křehké.
Krystaly – jedná se o pevné látky s uspořádaným uspořádáním strukturních jednotek (atomů, iontů, molekul).
Na základě jejich struktury existují čtyři typy krystalů: atomové, iontové, molekulární a kovové. Liší se svými vlastnostmi.
Otázky, úkoly, úkoly
1. Jaké jsou hlavní rozdíly mezi látkami molekulární a nemolekulární struktury? Dát příklad.
2. Porovnejte vlastnosti atomových, molekulárních, iontových a kovových krystalů.
3. Vysvětlete, proč iontové a molekulární krystaly prakticky nevedou elektrický proud. Co určuje dobrou elektrickou a tepelnou vodivost kovových krystalů?
4. Mohou látky vést proud?
- a) s iontovou vazbou;
- b) kovalentní vazba?
Uveďte příklady a podmínky projevu elektrické vodivosti těmito látkami.
5. Určete typy chemických vazeb a typy krystalů látek, jejichž vzorce jsou: SO2, SiС, CsF, K2SO4Cu6Sn5.
6. Designér potřeboval velmi tvrdou hmotu, která by byla odolná vůči vysokým teplotám a rozpouštědlům. Které ze sloučenin uvedených v problému 5 může použít ve svých testech?
7. Vysvětlete, proč je grafit elektricky vodivý a diamant ne.
8. Alloy Rosé (tsq +94 °C) se používá v elektrických pojistkách a také v radiotechnice jako pájka. Složení slitiny (hmotnostní): olovo (25 %), vizmut (50 %), cín (25 %). Uveďte typ jeho krystalů. Vypočítejte hmotnost každé součásti potřebnou k výrobě slitiny o hmotnosti 5 kg.
9. Vypočítejte molární poměr složek ve Woodově slitině. Woodova slitina je těžká, tavitelná slitina, vynalezená v roce 1860 americkým zubařem Woodem. Teplota tání – 68,5 °C. Složení (hmotnostní zlomky): cín – 12,5%, olovo – 25%, vizmut – 50%, kadmium – 12,5%. Jaké další fyzikální vlastnosti by podle vás tato slitina mohla mít?
10. Určete počet atomů v 1g podílu jedné z nejtvrdších syntetických látek, kterou je binární sloučenina boru a dusíku BN.
![]()
*Sebeovládání
1. Existují typy krystalů:
- a) atomový;
- b) iontové;
- c) kovalentní;
- d) molekulární.
2. Iontové krystaly mají látku o složení:
3. Atomové krystaly tvoří:
4. Molekulární krystaly tvoří:
5. Látky v páru jsou plastické a křehké:













